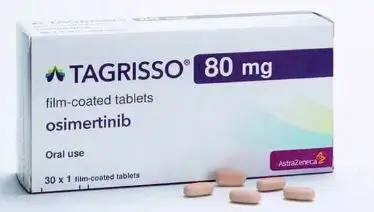
Thuốc Tagrisso Osimertinib 80mg AstraZeneca điều trị ung thư phổi (Hộp 30 viên)
Đặt mua Thuốc Tagrisso Osimertinib 80mg AstraZeneca điều trị ung thư phổi (Hộp 30 viên)
Thuốc Tagrisso Osimertinib 80mg AstraZeneca điều trị ung thư phổi (Hộp 30 viên)
Liên hệ để biết giá
Còn hàng
Bạn vui lòng nhập đúng số điện thoại để chúng tôi sẽ gọi xác nhận đơn hàng trước khi giao hàng. Xin cảm ơn!






Hãy là người đầu tiên nhận xét “Thuốc Tagrisso Osimertinib 80mg AstraZeneca điều trị ung thư phổi (Hộp 30 viên)”